
其實生活中有很多電鍍電鑄等標牌,但是,每個可能都看起來亮晶晶的表面感覺有點脆脆的像鏡子,但是其實很硬,你知道他是怎么做出來的嘛,知道什么原理嗎?
首先,您必須確定通電時要發生的化學反應或反應,從而選擇正確的電極和電解質。鍍在物體上的金屬原子來自電解液,所以如果你想鍍銅,你需要一種由銅鹽溶液制成的電解液,而對于鍍金,你需要一種基于金的電解液——等等.
接下來,您必須確保要電鍍的電極完全干凈。否則,當電解質中的金屬原子沉積在其上時,它們將無法形成良好的鍵合,并且可能會再次被擦掉。通常,清潔是通過將電極浸入強酸或強堿溶液中或通過(簡要)反向連接電鍍電路來完成的。如果電極真的很干凈,電鍍金屬中的原子會通過非常牢固地連接到其晶體結構的外邊緣來有效地結合到電極上。
現在我們已準備好進行電鍍的主要部分。我們需要兩個由不同導電材料制成的電極、電解質和電源。通常,其中一個電極是由我們要電鍍的金屬制成的,而電解質是同一種金屬的鹽溶液。因此,例如,如果我們要鍍銅一些黃銅,我們需要一個銅電極、一個黃銅電極和一種銅基化合物的溶液,例如硫酸銅溶液。金和銀等金屬不易溶解,因此必須使用強烈且危險且令人不快的氰化物基化學品制成溶液。將被電鍍的電極通常由較便宜的金屬或涂有導電材料(例如石墨)的非金屬制成。無論哪種方式,
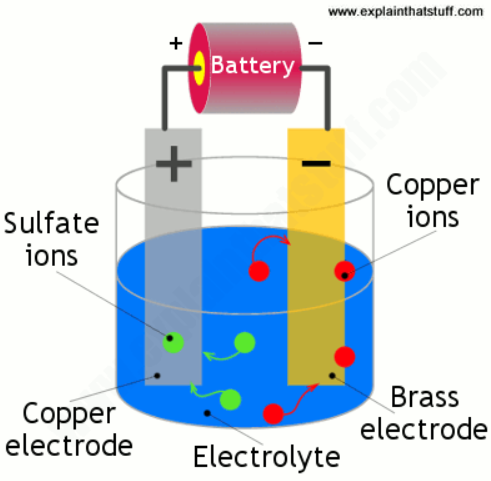
圖稿:鍍銅黃銅:您需要一個銅電極(灰色,左)、一個黃銅電極(黃色,右)和一些硫酸銅溶液(藍色)。黃銅電極帶負電并從溶液中吸引帶正電的銅離子,這些銅離子附著在它上面并形成銅板的外涂層。
我們將兩個電極浸入溶液中并將它們連接成一個電路,使銅成為正極(或陽極),黃銅成為負極(或陰極)。當我們打開電源時,硫酸銅溶液分裂成離子(電子太少或太多的原子)。銅離子(帶正電)被帶負電的黃銅電極吸引并緩慢沉積在其上——產生一層薄薄的銅板。同時,硫酸根離子(帶負電)到達帶正電的銅陽極,釋放通過電池向黃銅負極移動的電子。
電鍍原子在負極表面積聚需要時間。具體多長時間取決于您使用的電流強度和電解液的濃度。增加其中任何一個都會增加離子和電子在電路中移動的速度以及電鍍過程的速度。只要離子和電子不斷移動,電流就會不斷流動,電鍍過程就會繼續。